GMP认证流程
1、申报企业到省局受理大厅提交认证申请和申报材料
2、省局品处对申报材料形式审查 (5个工作日)
3、认证中心对申报材料进行技术审查 (10个工作日)
4、认证中心制定现场检查方案(10个工作日)
5、省局审批方案 (10个工作日)
6、认证中心组织实施认证现场检查 (10个工作日)
7、认证中心对现场检查报告进行初审 (10个工作日)
8、省局对认证初审意见进行审批(10个工作日)
9、报局发布审查公告(10个工作日)
食品GMP认证由美国在60年代发起,当前除美国已立法强制实施食品GMP外,其他如日本、 加拿大、新加坡、德国、澳洲、中国等国家均尚采取劝导方式 业者自动自发实施。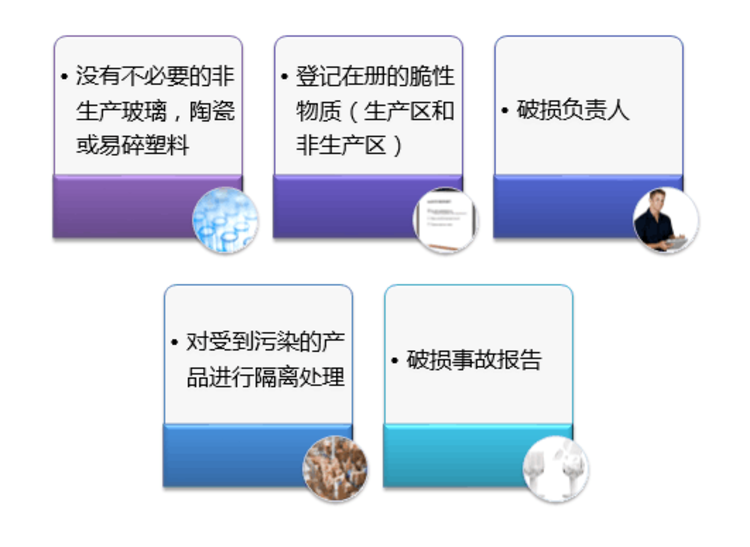
正确理解新版GMP相关要求
许多医药企业日益感到新版GMP认证之路的艰难。其中,相当部分的中小医药企业生产线较少,缺乏对法规变化的风险预测,其厂房设计和定期改造升级工作没有形成制度性规定,这些造成其在新版GMP大限之前进行长周期的改造任务。然而,停产面临丧失市场的威胁,而不停产面临出局威胁。